

C-Trap® — zaawansowany system do analizy pojedynczych biomolekuł
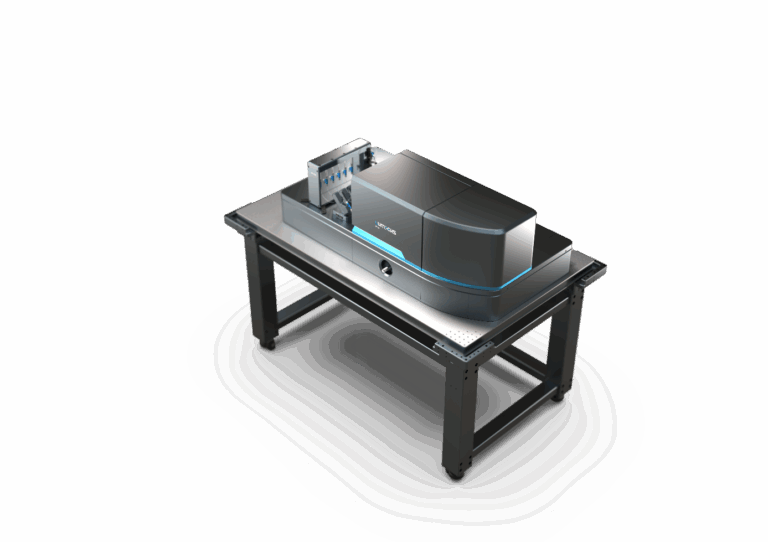
Technologia i kluczowe cechy systemu C-Trap®
C-Trap® to pierwsza na świecie platforma mikroskopowa umożliwiająca jednoczesne manipulowanie i wizualizowanie pojedynczych cząsteczek biologicznych w czasie rzeczywistym. System integruje trzy przełomowe technologie — szczypce optyczne (optical tweezers), mikroskopię fluorescencyjną i/lub bezznacznikową oraz mikrofluidykę laminarną, tworząc w pełni zsynchronizowane środowisko do badania mechanizmów molekularnych z niespotykaną rozdzielczością przestrzenno-czasową.
🔬 Technologia C-Trap® – jak to działa
1. Szczypce optyczne (optical tweezers)
Skupione wiązki laserowe tworzą pułapki optyczne, które mogą utrzymać i kontrolować mikroskopijne obiekty, takie jak kulki (beads), białka czy fragmenty DNA.
Umożliwia to:
- rozciąganie i zwalnianie cząsteczek w celu badania ich właściwości konformacyjnych i mechanicznych w czasie rzeczywistym,
- mierzenie sił generowanych przez białka motoryczne, enzymy i kompleksy białkowe,
- badanie właściwości mechanicznych filamentów cytoszkieletu, rozfałdowywanie białek, łączenie lub rozdzielanie kondensatów biomolekularnych w czasie rzeczywistym
2. Zintegrowana mikroskopia fluorescencyjna i bezznacznikowa (IRM, TIRF, mikroskopia konfokalna, STED)
Wbudowany system obrazowania pozwala obserwować dynamiczne procesy molekularne z nanometrową precyzją.
- mikroskopia konfokalna umożliwia analizę struktur 1D, np. DNA lub filamentów, z wielokolorową fluorescencją (do 3 barwników).
- TIRF eliminuje tło i idealnie nadaje się do obrazowania powierzchniowego.
- IRM pozwala wizualizować mikrotubule i inne struktury bez znakowania fluoroforami.
- STED Super-Resolution (opcjonalnie) zapewnia rozdzielczość poniżej 35 nm, pozwalając rozróżniać pojedyncze białka w bliskiej odległości.
3. Mikrofluidyka laminarnych przepływów
Pięciokanałowy układ mikrofluidyczny pozwala wprowadzać różne reagenty do oddzielnych strumieni bez fizycznych barier.
Dzięki temu badacz może:
- w czasie rzeczywistym przenosić cząsteczki między kanałami,
- zmieniać warunki eksperymentalne (np. stężenia białek, soli, ligandów),
- obserwować reakcje biochemiczne i mechaniczne w różnych środowiskach.
⚙️ Kluczowe cechy systemu
- Najwyższa rozdzielczość siły i czasu
-
-
- czułość poniżej 0,1 pN,
- stabilność pomiaru poniżej 0,3 pN przez 2 min,
- prędkość akwizycji do 78 kHz.
-
- Precyzyjna manipulacja przestrzenna
-
-
- rozdzielczość ruchu <3 nm,
- pole robocze 50 × 50 × 9 µm,
- do 4 niezależnych pułapek optycznych.
-
- Intuicyjne oprogramowanie BlueLake™
-
-
- automatyzacja eksperymentów i analizy danych,
- możliwość tworzenia skryptów(Python),
- zbieranie 18 zestawów danych w mniej niż 30 minut,
- integracja z platformą Harbor – repozytorium skryptów i protokołów użytkowników.
-
- Stabilność i powtarzalność
-
-
- aktywna kompensacja dryfu (Active Trap Stabilization),
- możliwość pracy w długich pomiarach równowagowych (>30 min),
- dedykowane zestawy do badań.
-
- Dwa warianty konstrukcyjne
- C-Trap® Dymo – zoptymalizowany do eksperymentów w roztworze (DNA, białka, interakcje enzymatyczne).
- C-Trap® Edge – przeznaczony do pomiarów na powierzchni, z integracją IRM i TIRF, idealny do badań cytoszkieletu i mechanobiologii.
🌍 Dlaczego C-Trap® jest wyjątkowy
C-Trap® to jedyny system dynamic single-molecule umożliwiający:
- równoczesne śledzenie sił i obrazu fluorescencyjnego w czasie rzeczywistym,
- bezpośrednie wizualizowanie procesów biologicznych w skali pojedynczej cząsteczki,
- szybkie, powtarzalne i w pełni automatyczne eksperymenty,
- korelację między strukturą, funkcją i mechaniką biomolekuł.
Zastosowania C-Trap
1. Fałdowanie białek (Protein folding)

🔹 C-Trap w badaniach nad fałdowaniem białek
C-Trap pozwala obserwować procesy fałdowania, rozfałdowywania i błędnego fałdowania białek w czasie rzeczywistym. Dzięki połączeniu pomiaru siły i obrazowania fluorescencyjnego badacze mogą analizować zmiany konformacyjne pojedynczych cząsteczek białek, śledząc ich stabilność mechaniczną, przejścia strukturalne, prędkości fałdowania, wpływ białek opiekuńczych (chaperonów), a także wpływ i kofaktorów. System umożliwia także badanie, w jaki sposób mutacje lub czynniki środowiskowe wpływają na mechanikę białek, co dostarcza kluczowych informacji o mechanizmach chorób związanych z nieprawidłowym fałdowaniem, takich jak Alzheimer czy choroba Huntingtona.
🔬 Kluczowe funkcje systemu C-Trap w badaniach nad składaniem białek:
- Manipulacja pojedynczymi cząsteczkami: C-Trap pozwala na przyłączanie kulek do białek i ich umieszczanie w odpowiednich warunkach, umożliwiając badanie procesów fałdowania i rozfałdowania białek w czasie rzeczywistym.
- Obrazowanie w czasie rzeczywistym: System umożliwia wizualizację procesów fałdowania białek za pomocą mikroskopii fluorescencyjnej, co pozwala na analizę dynamiki tych procesów.
- Pomiar sił molekularnych: Dzięki pułapkom optycznym, C-Trap umożliwia precyzyjne mierzenie sił działających na pojedyncze cząsteczki białek, co jest kluczowe dla zrozumienia mechanizmów fałdowania.
🧬 Zastosowania badawcze:
- Analiza mechanizmów fałdowania białek: Badanie, w jaki sposób białka przyjmują swoje funkcjonalne struktury, co jest istotne dla zrozumienia ich roli w komórce.
- Badanie dynamiki procesów fałdowania: Obserwacja zmian w strukturze białek w odpowiedzi na różne bodźce, co pozwala na lepsze zrozumienie ich funkcji.
- Modelowanie chorób związanych ze fałdowaniem białek: Symulacja warunków patologicznych, takich jak zmiany w funkcjonowaniu białek, co może przyczynić się do lepszego zrozumienia mechanizmów chorób takich jak choroba Alzheimera.
🧪 Przykład eksperymentu:
W jednym z eksperymentów, zespół badawczy przyłączył białko kalmodulinę (CaM) do kulki polistyrenowej i umieścił ją w odpowiednich warunkach. Następnie, za pomocą systemu C-Trap, zaobserwowano proces fałdowania białka w czasie rzeczywistym, mierząc siły działające na białko oraz rejestrując zmiany w jego strukturze za pomocą mikroskopii fluorescencyjnej. Wyniki eksperymentu dostarczyły cennych informacji na temat mechanizmów fałdowania białek.
2. Interakcje DNA-białko (DNA-binding proteins)

🔹 C-Trap w badaniach interakcji DNA–białko
C-Trap umożliwia badanie interakcji między białkami a DNA na poziomie pojedynczych cząsteczek. Dzięki możliwości manipulowania odcinkiem DNA pomiędzy kulkami, można analizować kinetykę wiązania, dysocjacji i ruchu białek wiążących DNA, a także wpływ mutacji czy modyfikacji potranslacyjnych. System pozwala prowadzić eksperymenty w warunkach bliskich fizjologicznym, np. z użyciem ekstraktów jądrowych, co umożliwia obserwację procesów naprawy, replikacji i transkrypcji DNA w czasie rzeczywistym.
🔬 Kluczowe funkcje systemu C-Trap w badaniach interakcji DNA–białko:
- Manipulacja pojedynczymi cząsteczkami: C-Trap pozwala na przyłączanie kulek do pojedynczych cząsteczek DNA, umożliwiając ich manipulację i badanie interakcji z białkami w czasie rzeczywistym.
- Obrazowanie w czasie rzeczywistym: System umożliwia wizualizację interakcji DNA–białko za pomocą mikroskopii fluorescencyjnej, co pozwala na analizę dynamiki tych interakcji.
- Pomiar sił molekularnych: Dzięki pułapkom optycznym, C-Trap umożliwia precyzyjne mierzenie sił działających na pojedyncze cząsteczki, co jest kluczowe dla zrozumienia mechanizmów interakcji DNA–białko.
🧬 Zastosowania badawcze:
- Analiza mechanizmów naprawy DNA: Badanie, w jaki sposób białka naprawcze oddziałują z DNA, co jest istotne dla zrozumienia procesów naprawy DNA.
- Badanie dynamiki interakcji: Obserwacja zmian w strukturze i organizacji DNA w odpowiedzi na różne białka, co pozwala na lepsze zrozumienie ich roli w komórce.
- Modelowanie chorób związanych z interakcjami DNA–białko: Symulacja warunków patologicznych, takich jak zmiany w funkcjonowaniu białek, co może przyczynić się do lepszego zrozumienia mechanizmów chorób takich jak nowotwory.
🧪 Przykład eksperymentu:
W jednym z eksperymentów, zespół badawczy przyłączył białko HU do kulki i umieścił ją na nici DNA. Następnie, za pomocą systemu C-Trap, zaobserwowano interakcję białka z DNA w czasie rzeczywistym, mierząc siły działające na DNA oraz rejestrując zmiany w jego strukturze. Wyniki eksperymentu dostarczyły cennych informacji na temat mechanizmów interakcji DNA–białko w różnych warunkach jonowych i konformacjach DNA
3. Separacja faz (Phase separation)

🔹 C-Trap w badaniach separacji faz
C-Trap umożliwia bezpośrednie badanie kondensatów biomolekularnych – dynamicznych kropli białkowych i nukleoproteinowych powstających w wyniku separacji faz. Dzięki precyzyjnej manipulacji pułapkami optycznymi i kontrolowanym przepływom mikrofluidycznym, badacze mogą obserwować, jak białka tworzą, łączą się i rozdzielają w kondensaty w czasie rzeczywistym. System pozwala także analizować wpływ warunków środowiskowych, takich jak stężenie soli czy cząsteczek crowdingowych, oraz modelować zaburzenia separacji faz występujące w chorobach neurodegeneracyjnych i nowotworowych.
🔬 Kluczowe funkcje systemu C-Trap w badaniach separacji faz:
- Manipulacja pojedynczymi cząsteczkami: C-Trap pozwala na przyłączanie kulek do białek lub cząsteczek RNA, umożliwiając ich manipulację i badanie interakcji w czasie rzeczywistym.
- Obrazowanie w czasie rzeczywistym: System umożliwia wizualizację procesów separacji faz za pomocą mikroskopii fluorescencyjnej, co pozwala na analizę dynamiki tych procesów.
- Pomiar sił molekularnych: Dzięki pułapkom optycznym, C-Trap umożliwia precyzyjne mierzenie sił działających na pojedyncze cząsteczki, co jest kluczowe dla zrozumienia mechanizmów separacji faz.
🧬 Zastosowania badawcze:
- Analiza dynamiki kropli białkowych: Badanie, w jaki sposób białka tworzą i łączą się w dynamiczne krople, co jest istotne dla zrozumienia procesów takich jak transkrypcja czy naprawa DNA.
- Badanie wpływu czynników zewnętrznych na separację faz: Obserwacja, jak zmiany w warunkach środowiskowych, takich jak obecność cząsteczek crowdingowych, wpływają na procesy separacji faz.
- Modelowanie chorób związanych z separacją faz: Symulacja warunków patologicznych, takich jak zmiany w funkcjonowaniu białek, co może przyczynić się do lepszego zrozumienia mechanizmów chorób neurodegeneracyjnych czy nowotworowych.
🧪 Przykład eksperymentu:
W jednym z eksperymentów, zespół badawczy przyłączył białko FUS do kulek polistyrenowych i umieścił je w odpowiednich warunkach. Następnie, za pomocą systemu C-Trap, zaobserwowano proces łączenia się tych białek w krople fazy rozproszonej. Mierząc czas potrzebny na relaksację kropli w różnych stężeniach PEG8000, badacze odkryli, że obecność cząsteczek crowdingowych znacząco spowalnia proces łączenia się kropli, co dostarcza cennych informacji na temat mechanizmów separacji faz w komórce.
4. Mechanobiologia (Mechanobiology)
🔹 C-Trap w badaniach mechanobiologicznych
C-Trap pozwala na precyzyjne manipulowanie i obserwowanie interakcji między komórkami, białkami i ich środowiskiem w skali molekularnej. Integracja pomiaru siły z obrazowaniem fluorescencyjnym pozwala badać mechanizmy generowania, przekazywania i percepcji sił w układach biologicznych na poziomie pojedynczych białek.
🔬 Kluczowe funkcje systemu C-Trap w badaniach mechanobiologicznych:
- Manipulacja pojedynczymi cząsteczkami: C-Trap pozwala na przyłączanie kulek do białek lub komórek, umożliwiając ich manipulację i badanie interakcji w czasie rzeczywistym.
- Obrazowanie w czasie rzeczywistym: System umożliwia wizualizację interakcji między komórkami, białkami i ich środowiskiem za pomocą mikroskopii fluorescencyjnej oraz obrazowania w podczerwieni (IRM), co pozwala na analizę dynamiki tych interakcji.
- Pomiar sił molekularnych: Dzięki pułapkom optycznym, C-Trap umożliwia precyzyjne mierzenie sił działających na pojedyncze cząsteczki lub komórki, co jest kluczowe dla zrozumienia mechanizmów mechanobiologicznych.
🧬 Zastosowania badawcze:
- Analiza mechanizmów segregacji chromosomów: Badanie, w jaki sposób kompleksy kinetochorowe, takie jak Dam1 i Ndc80, reagują na siły działające podczas podziału komórkowego.
- Badanie propagacji napięcia w błonie komórkowej: Obserwacja, jak wypustki aktynowe generują propagację napięcia w błonie komórkowej, co jest istotne dla zrozumienia odpowiedzi komórek na bodźce mechaniczne.
- Modelowanie chorób związanych z mechanobiologią: Symulacja warunków patologicznych, takich jak zmiany w funkcjonowaniu białek motorowych, co może przyczynić się do lepszego zrozumienia mechanizmów chorób takich jak rak, choroby neurodegeneracyjne czy zaburzenia w funkcjonowaniu układu odpornościowego.
🧪 Przykład eksperymentu:
W jednym z eksperymentów, zespół badawczy przyłączył kompleksy kinetochorowe Ndc80 do mikrokulek i umieścił je na mikrotubulach. Następnie, za pomocą systemu C-Trap, zaobserwowano reakcję tych kompleksów na siły działające podczas podziału komórkowego. Pomiar sił zrywających pozwolił na ocenę odporności kompleksów Ndc80 na siły działające podczas segregacji chromosomów, co dostarczyło cennych informacji na temat mechanizmów podziału komórkowego.
5. Struktura i transport cytoszkieletu (Cytoskeletal structure and transport)

🔹 C-Trap w badaniach struktury i transportu cytoszkieletu
C-Trap stanowi unikalne narzędzie do badania dynamiki i organizacji cytoszkieletu na poziomie pojedynczych cząsteczek. Umożliwia śledzenie aktywności białek motorycznych, dynamiki filamentów aktynowych i mikrotubul oraz mechanicznych właściwości kompleksów cytoszkieletowych w czasie rzeczywistym. Dzięki integracji technik optycznych i mikroskopowych (TIRF, IRM), badacze mogą bezpośrednio obserwować procesy transportu i generowania sił w pobliżu powierzchni komórkowej.
🔬 Kluczowe funkcje systemu C-Trap w badaniach cytoszkieletu:
- Manipulacja pojedynczymi cząsteczkami: C-Trap pozwala na przyłączanie kulek do białek motorycznych (np. kinezyna) i ich umieszczanie na filamentach cytoszkieletu, takich jak mikrotubule. Dzięki temu możliwe jest badanie interakcji białek motorycznych z filamentami w czasie rzeczywistym.
- Obrazowanie w czasie rzeczywistym: System umożliwia wizualizację interakcji białek motorycznych z filamentami cytoszkieletu za pomocą mikroskopii fluorescencyjnej (w tym TIRF) oraz obrazowania w podczerwieni (IRM), co pozwala na analizę dynamiki tych interakcji.
- Pomiar sił molekularnych: Dzięki pułapkom optycznym, C-Trap umożliwia precyzyjne mierzenie sił działających na pojedyncze cząsteczki, co jest kluczowe dla zrozumienia mechanizmów transportu w komórkach.
🧬 Zastosowania badawcze:
- Analiza mechanizmów transportu: Badanie, w jaki sposób białka motoryczne, takie jak kinezyna i dyneina, przemieszczają się wzdłuż filamentów cytoszkieletu, co jest istotne dla zrozumienia procesów transportu wewnątrzkomórkowego.
- Badanie dynamiki filamentów cytoszkieletu: Obserwacja zmian w strukturze i organizacji filamentów aktynowych i mikrotubul w odpowiedzi na różne bodźce, co pozwala na lepsze zrozumienie ich roli w komórce.
- Modelowanie chorób neurodegeneracyjnych: Symulacja warunków patologicznych, takich jak zmiany w funkcjonowaniu białek motorycznych, co może przyczynić się do lepszego zrozumienia mechanizmów chorób takich jak choroba Alzheimera.
🧪 Przykład eksperymentu:
W jednym z eksperymentów, zespół badawczy przyłączył białko motoryczne - kinezynę do kulki polistyrenowej i umieścił ją na mikrotubuli. Następnie, za pomocą systemu C-Trap, zaobserwowano ruch kinezyny wzdłuż mikrotubuli oraz zmierzono siły działające podczas tego procesu. Obrazowanie w podczerwieni (IRM) pozwoliło na dokładną wizualizację interakcji białka motorycznego z filamentem cytoszkieletu w czasie rzeczywistym.